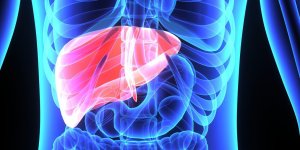
En janvier dernier, l’Agence nationale du médicament (ANSM) décidait de limiter l’usage du Lutényl et du Lutéran à cause d’un risque accru de méningiome, une tumeur cérébrale le plus souvent bénigne. Ainsi, ces deux pilules ne doivent plus être prescrites en cas de ménopause, d’irrégularités du cycle menstruel, de syndrome prémenstruel, de mastodynies légères (douleurs aux seins) et de contraception.
Avec leurs génériques, ces progestatifs ne sont plus recommandés qu’en cas cas d’endométriose, d’hémorragies fonctionnelles, de ménorragies (règles très abondantes) liées aux fibromes et de mastopathie sévère (maladie du sein non cancéreuse), sur une durée la plus courte possible.
Un document d’information obligatoire pour les patientes
"Les médecins prescripteurs de Lutényl, Lutéran ou leurs génériques doivent désormais remettre aux patientes concernées un document d’information présentant le risque de méningiome associé à ces médicaments", a décrété l’ANSM.
L’Agence du médicament ajoute que si "le traitement est poursuivi au-delà d’un an, toute dispensation de ces médicaments en pharmacie nécessitera de présenter une attestation annuelle d’information cosignée par la patiente et son médecin”. Des mesures déjà obligatoires depuis le 1er juillet 2021 pour les initiations de traitement et qui le deviendront le 1er janvier 2022 pour les renouvellements.
Lutényl et Lutéran : des risques pas toujours connus
L’objectif de cette nouvelle mesure est de mieux informer les femmes sur le risque de méningiome. En effet, d’après deux études observationnelles conduites par le groupement d'intérêt scientifique Epi-Phare, l’utilisation prolongée de l’acétate de nomégestrol (Lutényl et génériques) et de l’acétate de chlormadinone (Lutéran et génériques) est bien associée à un risque accru de méningiomes.
Les femmes dont la durée de traitement dépasse six mois voient leur risque de méningiome multiplié par trois par rapport aux femmes non exposées à ces médicaments. Ce risque est d’autant plus élevé que la dose utilisée est forte et la durée du traitement est longue :
- Il est multiplié par 12 après 5 ans de traitement par Lutényl (5 mg par jour pendant 20 jours par mois) ;
- Il est multiplié par 7 après 3,5 ans de traitement par Lutéran (10 mg par jour pendant 20 jours par mois).
“Les symptômes cliniques pouvant évoquer un méningiome sont notamment des maux de tête, des troubles de la vision, du langage, de l’audition, ou bien des convulsions”, détaille l’Agence du médicament.
Surveillance régulière par IRM cérébrale
L’ANSM précise également les modalités du suivi par imagerie à effectuer au cours du traitement. Ainsi selon l’ANSM, une imagerie cérébrale (IRM) de contrôle doit être réalisée :
- au début du traitement uniquement en cas de facteurs de risque de méningiome identifiés (antécédent de radiothérapie encéphalique dans l’enfance ou neurofibromatose de type 2) ;
- à tout moment pendant ou après le traitement en cas de signes évocateurs de méningiomes ;
- au bout d’un an de traitement lorsque celui-ci nécessite d’être poursuivi.
“En cas de découverte d’un méningiome, le traitement devra être arrêté définitivement et un avis neurochirurgical sera requis”, indique l’ANSM.
https://ansm.sante.fr/actualites/lutenyl-luteran-des-documents-pour-garantir-linformation-des-femmes-sur-laugmentation-du-risque-de-meningiome
https://www.ameli.fr/assure/actualites/luteran-lutenyl-la-prevention-du-risque-de-meningiome-est-renforcee
Recevez encore plus d'infos santé en vous abonnant à la quotidienne de Medisite.
Votre adresse mail est collectée par Medisite.fr pour vous permettre de recevoir nos actualités. En savoir plus.